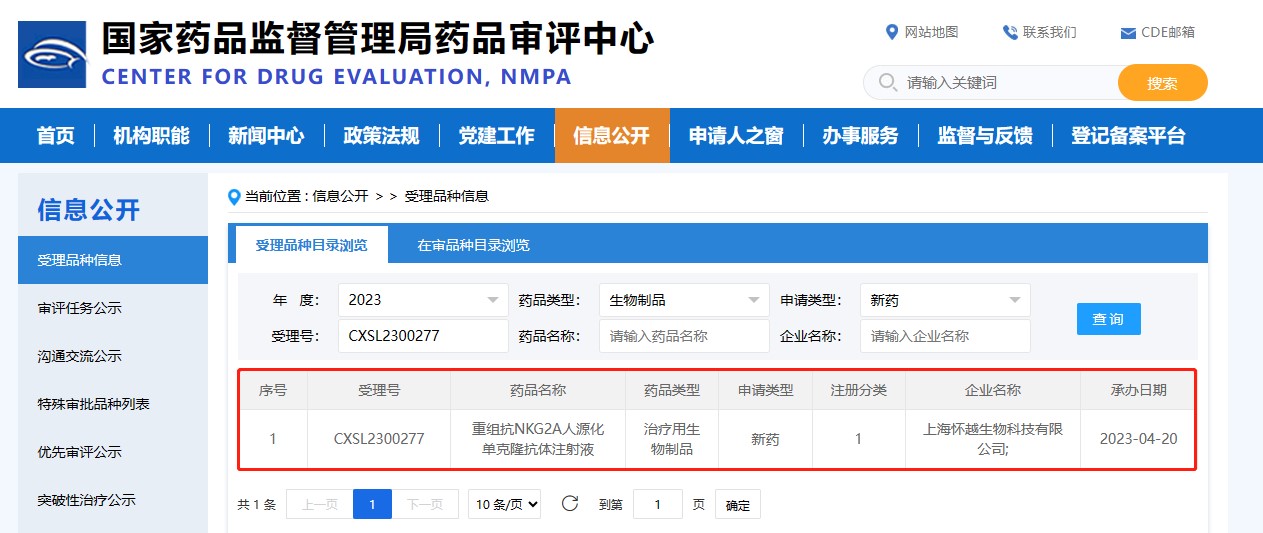
2023年6月23日,上海怀越生物科技有限公司(以下简称“怀越生物”)宣布其自主研发的重组抗NKG2A人源化单克隆抗体注射液(HY-0102注射液)临床试验申请正式获国家药品监督管理局批准,受理号:CXSL2300277,旨在评估HY0102单药治疗在局部晚期/转移性实体瘤患者中的安全性、耐受性、药代动力学和初步抗肿瘤活性。
HY-0102注射液是一种靶向自然杀伤细胞凝集素样受体亚家族C成员1(NKG2A)的人源化单克隆抗体,通过特异性结合NKG2A并阻断其与配体HLA-E之间的相互作用,释放了NKG2A对免疫应答的抑制,恢复机体免疫反应,从而促进T细胞和NK细胞的抗肿瘤能力。
HY-0102注射液已于2021年5月7日获得FDA临床试验默示许可(NCT04914351),目前已完成了美国 Ⅰ 期临床剂量爬坡研究。该试验成功入组17例受试者,分别进入6个梯队治疗,最高剂量10mg/kg,均未观察到DLT事件,且无3级以上不良事件发生,最长在组周期超过45周,药品展现出极好的安全性及耐受性。在未限定瘤种的实体瘤入组受试者中,有三例受试者取得了积极的治疗效果:一例膀胱癌受试者(2mpk)及一例结直肠癌受试者(4mpk)分别在33周和45周的治疗期内持续评估为SD,一例胰腺癌受试者(10mpk)在最近的一次有效性评估中更是达到了PR。
HY-0102注射液是NK领域充满潜力的全新免疫检查点抑制剂,属于境内外均未上市的治疗用生物制品,国内开发进展最快,全球前三的单抗药物。怀越生物希望通过HY-0102在中国开展 I期临床治疗项目,能为癌症患者带来更优的治疗方案。
